Carboidrati
I carboidrati sono una classe di composti costituiti da idrogeno, carbonio e ossigeno, il cui nome è dovuto al fatto che esso venne suggerito inizialmente per indicare un gruppo di composti organici, isolabili da sostanze naturali, di formula generale Cn(H2O)m, formalmente corrispondenti a idrati del carbonio. Dal punto di vista chimico i carboidrati corrispondono a polidrossialdeidi o polidrossichetoni oppure a composti in grado di produrre queste molecole per idrolisi. Questa definizione identifica immediatamente i gruppi funzionali presenti: gruppo aldeidico (CHO), gruppo chetonico (C=O) e funzioni alcoliche OH. La presenza simultanea dei gruppi OH e del gruppo aldeidico o chetonico, tuttavia, fa sì che la forma effettiva prevalente sia quella emiacetalica o emichetalica come vedremo nel seguito. Nella nomenclatura usualmente utilizzata per questi composti, vengono indicati come monosaccaridi o monosi i carboidrati che non sono in grado, per idrolisi, di dar luogo a zuccheri più semplici, il termine disaccaride indica uno zucchero in grado di fornire due unità monosaccaridiche, il termine trisaccaride tre unità monosaccaridiche e cosi via. I termini oligosaccaride e polisaccaride indicano, invece, zuccheri che, idrolizzati, danno da 2 a 10 molecole di monosaccaride o più di 10 rispettivamente. Esempi di monosaccaridi fortemente diffusi in natura sono il glucosio e il fruttosio, disaccaridi molto comuni sono il saccarosio (il comune zucchero da tavola) che può essere scisso in una molecola di glucosio e una di fruttosio e il maltosio che invece, idrolizzato, dà due unità di glucosio. Un polisaccaride estremamente diffuso è la cellulosa. La cellulosa, come anche l'amido, non è altro che un polimero del glucosio. Entrambi, sottoposti a idrolisi, danno molte unità di glucosio.
I monosaccaridi si possono classificare in base
- al numero di atomi di carbonio presenti nella molecola (si utilizzano i termini triosi, tetrosi, pentosi, esosi, per indicare tre, quattro, cinque, sei atomi di carbonio rispettivamente) oppure
- in base alla funzione aldeidica (aldosi) o chetonica (chetosi) presente.
Le due diverse terminologie si possono combinare tra di loro; così, un monosaccaride con sei atomi di carbonio e una funzione aldeidica diventa un aldoesoso, mentre se gli atomi di carbonio sono cinque e la funzione è di tipo chetonico si parla di chetopentoso
Struttura dei carboidrati: monosaccaridi
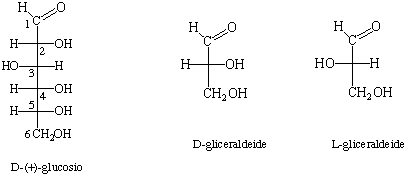
Figura 1. Struttura lineare del D-(+)-glucosio (secondo la proiezione di Fisher)
e rappresentazione dei due enantiomeri D e L della gliceraldeide.
Esaminiamo in dettaglio la struttura del monosaccaride più diffuso in natura: il D-(+)-glucosio, un aldoesoso, mostrato in Figura 1. Il simbolo (+) indica che questo zucchero, come gli altri monosaccaridi, è otticamente attivo e ha la capacità di ruotare in senso orario il piano della luce polarizzata. Il simbolo D fa riferimento all'ultimo carbonio chirale (C5) e indica che la configurazione di quest'ultimo è la stessa del carbonio chirale della D-gliceraldeide. I due enantiomeri D e L della gliceraldeide sono mostrati anch'essi in Figura 1. La configurazione D o L della gliceraldeide può essere collegata facilmente a quella dei monosi, poiché tutti i monosi possono essere preparati a partire da questa molecola mediante una serie di allungamenti successivi della catena di atomi di carbonio (sintesi di Kiliani-Fisher). Per questo motivo si dice che un monosaccaride è di serie D o serie L a seconda che l'ultimo atomo di carbonio chirale della catena abbia la stessa configurazione della D o della L-gliceraldeide.
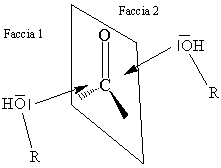
Figura 2. Rappresentazione schematica dell'attacco da parte del gruppo OH di
un alcool sul carbonio carbonilico: l'attacco puo' avvenire su entrambe le facce
del piano molecolare e porta alla formazione di due atomi di carbonio chirali
con configurazione opposta. R indica lo scheletro residuo della molecola
contenente la funzione alcolica.
La forma prevalente nella quale si trova il glucosio non è, in
realtà, quella lineare corrispondente alla proiezione di Fisher e
mostrata
in Figura 1, ma una struttura ciclica, corrispondente, da un punto di vista
chimico, ad un emiacetale. La struttura ciclica emiacetalica si
forma in seguito all'attacco da parte dell'ossigeno (nucleofilo) della
funzione alcolica (gruppo OH) legata al carbonio 5 sul carbonio
carbonilico (elettrofilo) della funzione aldeidica CHO. Poiché
il carbonio carbonilico, caratterizzato da una ibridizzazione sp2,
ha una struttura planare (i tre leganti del carbonio e il carbonio
stesso stanno tutti sul medesimo piano), l'attacco da parte del gruppo
OH può avvenire su entrambe le facce del piano della molecola
(i due possibili attacchi sono schematizzati in Figura 2). Questo ha
una conseguenza molto importante: il nuovo centro chirale che si
forma in seguito all'attacco, può avere due diverse configurazioni
a seconda della faccia sulla quale tale attacco è avvenuto. Per
questo motivo le corrispondenti forme cicliche risultanti non sono altro
che due diversi diastereoisomeri che differiscono per la sola
configurazione del nuovo centro chirale che si è formato (la
configurazione di tutti gli altri centri chirali rimane invariata
rispetto alla forma aperta). Esse vengono indicate con il termine
specifico di anomeri: anomero ![]() e anomero
e anomero ![]() . I due anomeri
sono rappresentati in Figura 3 secondo due diverse convenzioni. La
prima rappresentazione (in alto) è stata ottenuta utilizzando
le formule di Haworth. Come si vede nel caso dell'anomero
. I due anomeri
sono rappresentati in Figura 3 secondo due diverse convenzioni. La
prima rappresentazione (in alto) è stata ottenuta utilizzando
le formule di Haworth. Come si vede nel caso dell'anomero
![]() il gruppo OH legato al carbonio
emiacetalico (C1) è in posizione cis rispetto al
gruppo OH adiacente, mentre nel caso dell'anomero
il gruppo OH legato al carbonio
emiacetalico (C1) è in posizione cis rispetto al
gruppo OH adiacente, mentre nel caso dell'anomero
![]() esso si trova in posizione
trans. Una migliore rappresentazione, che riproduce in modo
più realistico l'effettiva struttura tridimensionale della molecola,
è costituita dalle strutture a sedia riportate in basso in
Figura 3. Da queste strutture, che rappresentano le conformazioni
più stabili dei due anomeri, è evidente come i gruppi
più ingombranti attaccati agli atomi di carbonio dell'anello
(OH e CH2OH) siano in posizione equatoriale. Fa eccezione
il gruppo OH del carbonio C1 (carbonio anomerico) che è
equatoriale nel caso dell'anomero
esso si trova in posizione
trans. Una migliore rappresentazione, che riproduce in modo
più realistico l'effettiva struttura tridimensionale della molecola,
è costituita dalle strutture a sedia riportate in basso in
Figura 3. Da queste strutture, che rappresentano le conformazioni
più stabili dei due anomeri, è evidente come i gruppi
più ingombranti attaccati agli atomi di carbonio dell'anello
(OH e CH2OH) siano in posizione equatoriale. Fa eccezione
il gruppo OH del carbonio C1 (carbonio anomerico) che è
equatoriale nel caso dell'anomero ![]() ,
ma
diventa assiale nel caso dell'anomero
,
ma
diventa assiale nel caso dell'anomero ![]() .
La posizione assiale del gruppo OH è responsabile della minore
stabilità dell'anomero
.
La posizione assiale del gruppo OH è responsabile della minore
stabilità dell'anomero ![]() rispetto
a quello
rispetto
a quello ![]() . La diversa energia dei due
anomeri fa sì che in soluzione il
. La diversa energia dei due
anomeri fa sì che in soluzione il ![]() -D-glucosio
sia notevolmente più abbondante (circa 64%)
dell'
-D-glucosio
sia notevolmente più abbondante (circa 64%)
dell'![]() -D-glucosio (circa 36%). In
realtà in soluzione si instaura un equilibrio fra le due forme
emiacetaliche e la forma aperta aldeidica che è presente in
una percentuale molto bassa (circa 0,02%).
-D-glucosio (circa 36%). In
realtà in soluzione si instaura un equilibrio fra le due forme
emiacetaliche e la forma aperta aldeidica che è presente in
una percentuale molto bassa (circa 0,02%).
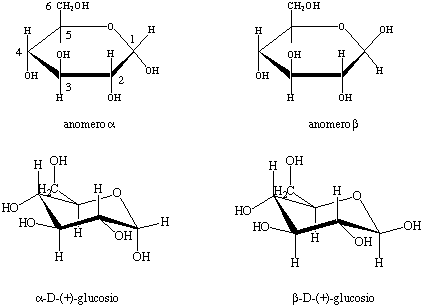
Figura 3. Proiezioni di Haworth (in alto) e conformazioni a sedia (in basso)
dei due anomeri ![]() e
e
![]() del D-(+)-glucosio.
del D-(+)-glucosio.
Questo equilibrio è responsabile di un fenomeno caratteristico di
molti zuccheri detto mutarotazione. Il D-(+)-glucosio può
essere isolato in due forme cristalline diverse corrispondenti a ciascuno
dei due anomeri: ![]() -D-glucosio e
-D-glucosio e
![]() -D-glucosio. I due anomeri, in quanto
diastereomeri, sono caratterizzati da proprietà fisiche diverse:
il primo, ad esempio, ha un punto di fusione di 146 °C e il secondo di
150 °C. Anche il potere rotatorio specifico delle soluzioni dei
due anomeri appena preparate è diverso: nel primo caso esso
è di +112°, nel secondo caso di +18,7°. Il fatto curioso che
però contraddistingue questa proprietà fisica è
il seguente: per entrambe le soluzioni acquose ottenute dai due
anomeri separati, essa cambia nel tempo fino a raggiungere in
entrambi i casi lo stesso valore di +52,6°. Questo fenomeno viene
interpretato sulla base dell'equilibrio fra le due forme
anomeriche e la forma aperta. L'anomero
-D-glucosio. I due anomeri, in quanto
diastereomeri, sono caratterizzati da proprietà fisiche diverse:
il primo, ad esempio, ha un punto di fusione di 146 °C e il secondo di
150 °C. Anche il potere rotatorio specifico delle soluzioni dei
due anomeri appena preparate è diverso: nel primo caso esso
è di +112°, nel secondo caso di +18,7°. Il fatto curioso che
però contraddistingue questa proprietà fisica è
il seguente: per entrambe le soluzioni acquose ottenute dai due
anomeri separati, essa cambia nel tempo fino a raggiungere in
entrambi i casi lo stesso valore di +52,6°. Questo fenomeno viene
interpretato sulla base dell'equilibrio fra le due forme
anomeriche e la forma aperta. L'anomero ![]() contenuto nella prima soluzione si converte lentamente, attraverso
la forma aperta, nell'anomero
contenuto nella prima soluzione si converte lentamente, attraverso
la forma aperta, nell'anomero ![]() fino a che
i due anomeri non raggiungono l'equilibrio. Lo stesso succede per la
seconda soluzione ottenuta a partire dall'anomero
fino a che
i due anomeri non raggiungono l'equilibrio. Lo stesso succede per la
seconda soluzione ottenuta a partire dall'anomero ![]() .
Il potere rotatorio finale misurato, pari a 52,6°, è quello
della miscela finale di equilibrio dei due anomeri.
.
Il potere rotatorio finale misurato, pari a 52,6°, è quello
della miscela finale di equilibrio dei due anomeri.
Un altro monosaccaride molto diffuso è il D-(-)-fruttosio. Il fruttsio è caratterizzato da un gruppo funzionale chetonico e da una catena di sei atomi di carbonio (si tratta quindi di un chetoesoso). La forma aperta di questo monosaccaride è rappresentata sotto forma di proiezione di Fisher in Figura 4. Anche in questo caso la presenza di funzioni alcoliche e di un gruppo carbonilico dà luogo alla formazione di strutture cicliche emiacetaliche. Oltre alla forma ciclica a sei membri descritta nel caso del glucosio, si forma in questo caso anche una struttura emiacetalica a cinque membri che deriva da un attacco del gruppo OH legato al carbonio C5 sul carbonio carbonilico (gruppo C=O). Anche in questo caso si possono avere due diverse forme anomere a seconda della direzione d'attacco del gruppo OH e della risultante configurazione del carbonio emiacetalico (C2). Le due forme anomere sono rappresentate, in Figura 4. Insieme alle strutture cicliche a sei membri esse sono in equilibrio con la forma aperta chetonica al centro.
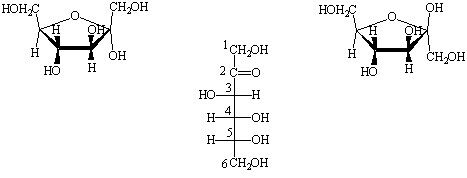
Figura 4. Rappresentazione del D-(-)-fruttosio in forma aperta chetonica
(proiezione di Fisher) e delle due forme emichetaliche furanosiche
![]() -D-(-)-fruttofuranosio
e
-D-(-)-fruttofuranosio
e ![]() -D-(-)-fruttofuranosio.
-D-(-)-fruttofuranosio.
Per indicare le dimensioni del ciclo è stato proposto per gli zuccheri
un sistema di nomenclatura che utilizza il termine piranosio per
l'anello a sei membri e il termine furanosio per l'anello a cinque membri
(i due termini derivano dal nome dei due composti eterociclici ossigenati
Pirano e Furano). Utilizzando questo tipo di nomenclatura i nomi completi per
i due anomeri del glucosio sono ![]() -D-(+)-glucopiranosio
e
-D-(+)-glucopiranosio
e ![]() -D-(+)-glucopiranosio; quelli per le quattro
forme emiacetaliche del fruttosio sono
-D-(+)-glucopiranosio; quelli per le quattro
forme emiacetaliche del fruttosio sono ![]() -D-(-)-fruttofuranosio
e
-D-(-)-fruttofuranosio
e ![]() -D-(-)-fruttofuranosio (anelli a cinque termini)
e
-D-(-)-fruttofuranosio (anelli a cinque termini)
e ![]() -D-(-)-fruttopiranosio e
-D-(-)-fruttopiranosio e
![]() -D-(-)-fruttopiranosio (anelli a sei termini).
-D-(-)-fruttopiranosio (anelli a sei termini).
La presenza all'equilibrio di una certa percentuale, per quanto ridotta di forma
aperta aldeidica o chetonica, è responsabile del fatto che sia il D-glucosio
che il D-fruttosio vengano ossidati dagli stessi reattivi in grado di ossidare
le aldeidi e gli ![]() -idrossichetoni.
I reattivi generalmente usati per ossidare i monosi sono i reattivi di Benedict e
di Tollens, l'acqua di bromo e l'acido nitrico. Il reattivo di Tollens, ad esempio,
è costituito da una soluzione acquosa di nitrato d'argento e ammoniaca.
In questa soluzione è presente il complesso Ag(NH3)2+,
un agente ossidante blando in grado di ossidare il gruppo aldeidico a gruppo
carbossilato COO-. L'argento contemporaneamente si riduce dallo
stato +1 ad argento metallico (stato di ossidazione 0), che si deposita sulle
pareti della provetta utilizzata per il saggio, formando uno specchio d'argento.
Gli zuccheri che danno saggio positivo con i reattivi di Tollens o Benedict
sono tutti i carboidrati caratterizzati dalla presenza di un gruppo emiacetalico
(come il glucosio) o emichetalico (come il fruttosio). Questi zuccheri sono
noti con il termine di zuccheri riducenti.
-idrossichetoni.
I reattivi generalmente usati per ossidare i monosi sono i reattivi di Benedict e
di Tollens, l'acqua di bromo e l'acido nitrico. Il reattivo di Tollens, ad esempio,
è costituito da una soluzione acquosa di nitrato d'argento e ammoniaca.
In questa soluzione è presente il complesso Ag(NH3)2+,
un agente ossidante blando in grado di ossidare il gruppo aldeidico a gruppo
carbossilato COO-. L'argento contemporaneamente si riduce dallo
stato +1 ad argento metallico (stato di ossidazione 0), che si deposita sulle
pareti della provetta utilizzata per il saggio, formando uno specchio d'argento.
Gli zuccheri che danno saggio positivo con i reattivi di Tollens o Benedict
sono tutti i carboidrati caratterizzati dalla presenza di un gruppo emiacetalico
(come il glucosio) o emichetalico (come il fruttosio). Questi zuccheri sono
noti con il termine di zuccheri riducenti.
Un monosaccaride può essere convertito in glicoside facendolo reagire
con un alcool in presenza di un acido. Un glicoside non è altro che
la forma acetalica di uno zucchero e come qualsiasi acetale si ottiene
per reazione, catalizzata da acidi, della forma emiacetalica con un alcool.
Il glicoside del glucosio si chiama glucoside, quello del fruttosio
fruttoside. Le due forme ![]() e
e
![]() del glicoside del glucosio ottenute per reazione con alcool metilico
(metil-
del glicoside del glucosio ottenute per reazione con alcool metilico
(metil-![]() -D-glucoside e
metil-
-D-glucoside e
metil-![]() -D-glucoside)
sono rappresentate in Figura 5. È importante mettere in evidenza che,
mentre per un monosaccaride in soluzione acquosa si ha sempre equilibrio fra
i due anomeri e la forma aperta, lo stesso non accade per un glicoside.
Un glicoside
-D-glucoside)
sono rappresentate in Figura 5. È importante mettere in evidenza che,
mentre per un monosaccaride in soluzione acquosa si ha sempre equilibrio fra
i due anomeri e la forma aperta, lo stesso non accade per un glicoside.
Un glicoside ![]() o
o
![]() ,
in quanto acetale, è stabile in soluzione acquosa e non si converte
nell'altro anomero. È quindi evidente che uno zucchero, se trasformato
in forma glicosidica (acetalica) non può dare mutarotazione, non
essendo presente all'equilibrio la forma aldeidica (o chetonica) libera.
Per lo stesso motivo i carboidrati che contengono gruppi acetalici (o chetalici)
non possono venire ossidati dai reattivi di Benedict e Tollens.
Per questo sono detti zuccheri non riducenti.
,
in quanto acetale, è stabile in soluzione acquosa e non si converte
nell'altro anomero. È quindi evidente che uno zucchero, se trasformato
in forma glicosidica (acetalica) non può dare mutarotazione, non
essendo presente all'equilibrio la forma aldeidica (o chetonica) libera.
Per lo stesso motivo i carboidrati che contengono gruppi acetalici (o chetalici)
non possono venire ossidati dai reattivi di Benedict e Tollens.
Per questo sono detti zuccheri non riducenti.
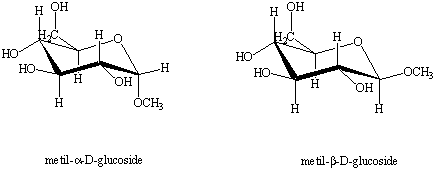
Figura 5. Conformazioni a sedia del
metil-![]() -D-glucoside e
metil-
-D-glucoside e
metil-![]() -D-glucoside.
-D-glucoside.
Struttura dei disaccaridi
Nei disaccaridi il legame che unisce le due unità monosaccaridiche è di tipo glicosidico e coinvolge il carbonio C1 di una unità (carbonio anomerico) e una funzione alcolica dell'altra unità. Esempi di disaccaridi importanti sono il maltosio, il saccarosio e il lattosio.
Il maltosio deve il proprio nome al fatto che è presente
nel malto, il liquido che si ottiene dalla fermentazione dell'orzo e di
altri cereali. Per idrolisi acida il maltosio fornisce due unità
di D-(+)- glucosio le quali sono unite da un legame glicosidico che
coinvolge il carbonio C1 (anomerico) di una unità e il carbonio
C4 dell'altra unità. La struttura del maltosio è
rappresentata in Figura 6. Il maltosio esiste sotto forma di due diverse
forme anomere che differiscono per la configurazione del carbonio
emiacetalico della seconda unità di glucosio e sono
caratterizzate da due diversi valori del potere rotatorio specifico
(![]() -maltosio > +168°,
-maltosio > +168°,
![]() -maltosio > +112°).
Come nel caso del glucosio e del fruttosio, la presenza di un carbonio emiacetalico
fa sì che i due anomeri siano in equilibrio fra di loro attraverso la
forma aldeidica aperta della seconda unità di glucosio. Il maltosio è
quindi caratterizzato dal fenomeno della mutarotazione ed è uno zucchero
riducente.
-maltosio > +112°).
Come nel caso del glucosio e del fruttosio, la presenza di un carbonio emiacetalico
fa sì che i due anomeri siano in equilibrio fra di loro attraverso la
forma aldeidica aperta della seconda unità di glucosio. Il maltosio è
quindi caratterizzato dal fenomeno della mutarotazione ed è uno zucchero
riducente.
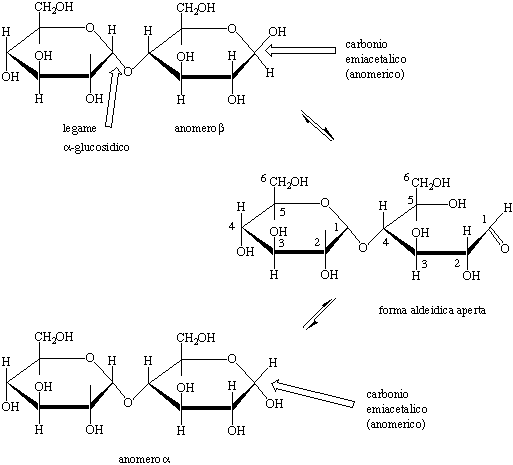
Figura 6. Anomeri ![]() e
e
![]() del maltosio in equilibrio con la forma aldeidica aperta.
del maltosio in equilibrio con la forma aldeidica aperta.
Il saccarosio, che costituisce il normale zucchero da tavola,
è ottenuto per estrazione dalla canna da zucchero e dalla
barbabietola. Il saccarosio fornisce per idrolisi acida una miscela
equimolare di D-glucosio e D-fruttosio. La struttura di questo disaccaride
è mostrata in Figura 7. I carboni carbonilici di entrambi i
monosaccaridi (C1 del glucosio e C2 del fruttosio) sono impegnati nella
formazione di legami glicosidici e sono quindi carboni di tipo acetalico (legame
![]() -glucosidico e
-glucosidico e ![]() -fruttosidico. Per questo motivi il saccarosio è uno zucchero non riducente. Esso è stabile in soluzione acquosa e non dà quindi mutarotazione.
-fruttosidico. Per questo motivi il saccarosio è uno zucchero non riducente. Esso è stabile in soluzione acquosa e non dà quindi mutarotazione.
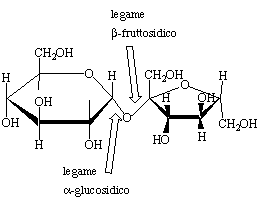
Figura 7. Struttura del (+)-saccarosio.
Per idrolisi parziale della cellulosa si ottiene il cellobosio.
Questo disaccaride differisce dal maltosio solo per la configurazione del
legame glucosidico: le due unità di glucosio che lo costituiscono
sono infatti unite da un legame ![]() -glucosidico
come risulta evidente dalla Figura 8, dove è rappresentato
l'anomero
-glucosidico
come risulta evidente dalla Figura 8, dove è rappresentato
l'anomero ![]() . Come il maltosio anche il
cellobosio, poiché contiene un carbonio emiacetalico, è
uno zucchero riducente ed è caratterizzato dal fenomeno della
mutarotazione.
. Come il maltosio anche il
cellobosio, poiché contiene un carbonio emiacetalico, è
uno zucchero riducente ed è caratterizzato dal fenomeno della
mutarotazione.
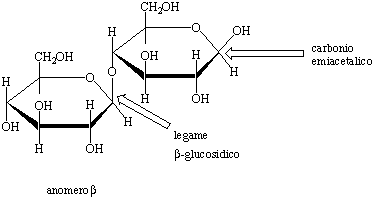
Figura 8. Struttura dell'anomero ![]() del cellobosio.
del cellobosio.
Polisaccaridi
Un polisaccaride è un composto la cui molecola è costituita da molte unità (centinaia e, a volte, migliaia) monosaccaradiche tenute insieme da legami glicosidici.
La cellulosa, oltre ad essere il polisaccaride più abbondante,
è anche il composto organico più diffuso in natura. Stime
approssimative indicano che ogni anno ne vengono sintetizzate circa
1011 tonnellate. Basta ricordare che il legno, ad esempio,
è composto da circa il 50% di cellulosa e il cotone da circa
il 90%. L'idrolisi completa della cellulosa (effettuata con una
soluzione di HCl al 40%) dà soltanto molecole di D-glucosio,
mentre l'idrolisi parziale fornisce cellobosio. Questo indica che
il legame che collega le varie unità monosaccaridiche è
di tipo ![]() -glucosidico. Anche se il disaccaride cellobosio è uno zucchero riducente e dà mutarotazione, questo non è vero per la cellulosa. Ciò può essere spiegato con il fatto che la probabile presenza di atomi di carbonio emiacetalici solo alla fine di lunghe catene polisaccaridiche (circa 14000 unità) non è sufficiente per osservare le reazioni tipiche associate alla presenza di un carbonio emiacetalico. Una rappresentazione schematica di un tratto di catena di cellulosa è dato in Figura 9.
-glucosidico. Anche se il disaccaride cellobosio è uno zucchero riducente e dà mutarotazione, questo non è vero per la cellulosa. Ciò può essere spiegato con il fatto che la probabile presenza di atomi di carbonio emiacetalici solo alla fine di lunghe catene polisaccaridiche (circa 14000 unità) non è sufficiente per osservare le reazioni tipiche associate alla presenza di un carbonio emiacetalico. Una rappresentazione schematica di un tratto di catena di cellulosa è dato in Figura 9.
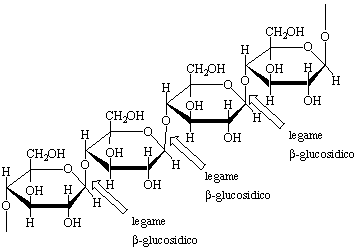
Figura 9. Struttura della cellulosa.
La struttura lineare delle catene di cellulosa fa sì che i gruppi OH, data la loro collocazione equatoriale sull'anello, siano uniformemente diretti verso l'esterno della catena. L'orientazione dei gruppi alcolici fa sì che le varie catene si possano associare saldamente fra di loro grazie alla formazione di legami idrogeno (ogni legame idrogeno coinvolge l'atomo di ossigeno del gruppo OH di una catena e l'idrogeno del gruppo OH di una catena parallela). Queste interazioni attrattive determinano un impaccamento delle varie catene di cellulosa dando luogo a un polimero rigido, fibroso, assai poco solubile e che possiede la resistenza ideale per costruire le pareti delle cellule vegetali.
Il polisaccaride più abbondante dopo la cellulosa è
l'amido, anch'esso formato da unità di glucosio: è
presente nelle piante sotto forma di granuli nelle radici, nei tuberi e
nei semi. L'amido può essere separato in due polisaccaridi
principali: amilosio e amilopectina. L'amilosio è
costituito da catene continue, non ramificate, di unità di
D-glucosio (se ne possono avere fino a 4000) e si differenzia dalla
cellulosa poiché le varie unità sono legate fra di loro
da legami ![]() -glicosidici. L'amilopectina
è un polisaccaride strutturalmente più complesso. Esso
è caratterizzato da una struttura molto ramificata e
contiene due tipi diversi di legami glicosidici: (a) un legame
-glicosidici. L'amilopectina
è un polisaccaride strutturalmente più complesso. Esso
è caratterizzato da una struttura molto ramificata e
contiene due tipi diversi di legami glicosidici: (a) un legame
![]() -glicosidico fra il carbonio C1
di una molecola di glucosio e il carbonio C4 della molecola
successiva come nel caso dell'amilosio; (b) un legame
-glicosidico fra il carbonio C1
di una molecola di glucosio e il carbonio C4 della molecola
successiva come nel caso dell'amilosio; (b) un legame
![]() -glicosidico fra gli atomi di
carbonio C1 e C6 di due unità di glucosio. I due
diversi legami sono mostrati in Figura 10 per un frammento
di polimero di amilopectina.
-glicosidico fra gli atomi di
carbonio C1 e C6 di due unità di glucosio. I due
diversi legami sono mostrati in Figura 10 per un frammento
di polimero di amilopectina.
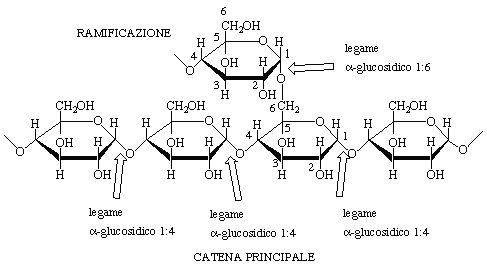 Figura 10. Struttura ramificata dell'amilopectina.
Figura 10. Struttura ramificata dell'amilopectina.